Éducation des professionnels de santé : comprendre les différences entre biosimilaires et génériques
 déc., 30 2025
déc., 30 2025
Si vous prescrivez des traitements pour l’arthrite, le cancer ou le diabète, vous avez probablement entendu parler des biosimilaires. Mais savez-vous vraiment ce qu’ils sont, et pourquoi ils ne sont pas les mêmes que les génériques ? Beaucoup de professionnels de santé, même expérimentés, confondent les deux. Et cette confusion a un coût : des patients qui hésitent à changer, des dossiers mal remplis, et des traitements qui ne sont pas utilisés à leur plein potentiel.
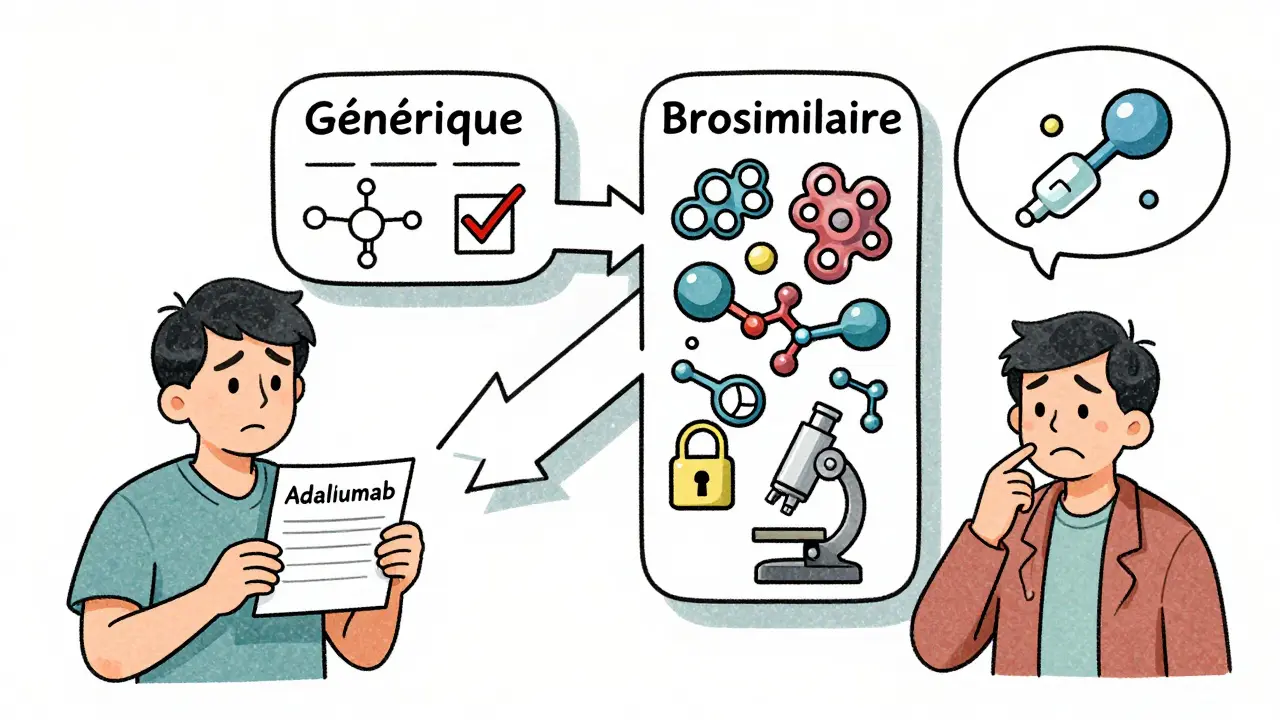
Les biosimilaires ne sont pas des génériques
Les génériques, vous les connaissez bien : ils copient une molécule chimique simple, comme le paracétamol ou l’ibuprofène. Leur fabrication est reproductible à l’identique. Un générique de metformine contient exactement la même substance active, dans la même forme, avec les mêmes excipients. C’est pour ça qu’on peut les remplacer sans vérification.
Les biosimilaires, eux, sont des copies de biologiques. Ce sont des médicaments fabriqués à partir de cellules vivantes - des protéines, des anticorps, des hormones. Prenons l’exemple de l’adalimumab, un traitement contre l’arthrite rhumatoïde. Le produit d’origine (Humira) est produit dans des cellules de hamster chinois. Un biosimilaire doit être fabriqué dans des cellules similaires, avec des processus presque identiques. Mais même avec les meilleures technologies, il est impossible de répliquer à 100 % la structure complexe d’une protéine humaine.
La FDA et l’EMA exigent que les biosimilaires soient très similaires au produit d’origine, avec aucune différence cliniquement significative. Cela signifie : même efficacité, même sécurité, même profil d’immunogénicité. Mais il peut y avoir de minimes variations dans les parties non actives - des sucres ou des acides aminés en plus ou en moins. Ces différences n’affectent pas le résultat thérapeutique, mais elles rendent impossible la substitution automatique comme avec un générique.
Comment prouver qu’un biosimilaire est sûr ?
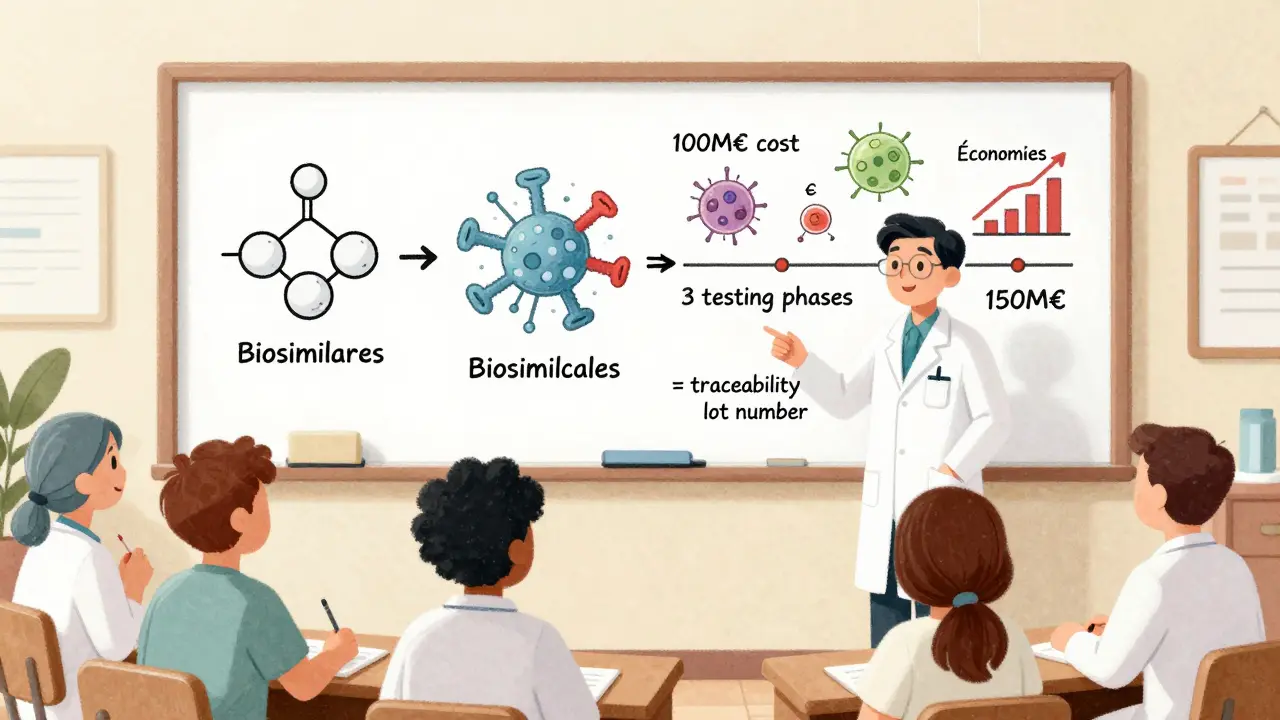
Un générique doit prouver seulement qu’il est bioéquivalent : il se dissout et se absorbe de la même manière que l’originale. Pour cela, on fait une étude sur 20 à 30 volontaires sains.
Un biosimilaire, lui, doit passer par trois niveaux de preuve :
- Analytique : Des centaines d’analyses chimiques et physiques pour comparer la structure, la pureté, la stabilité.
- Non clinique : Des études sur des animaux pour évaluer la toxicité et le comportement biologique.
- Clinique : Au moins une étude chez des patients, souvent avec des centaines de participants, pour comparer l’efficacité et la sécurité directement avec le produit d’origine.
Cela prend des années et coûte entre 100 et 200 millions d’euros - dix fois plus qu’un générique. Pourquoi tant d’efforts ? Parce qu’un changement minime dans la structure d’un anticorps peut déclencher une réponse immunitaire. Et si le système immunitaire reconnaît le médicament comme étranger, il peut le détruire… ou provoquer des effets secondaires graves.
Qu’est-ce qu’un biosimilaire « interchangeable » ?
Il existe une sous-catégorie : les biosimilaires interchangeables. Ceux-là ont passé une étude supplémentaire : les patients ont été switchés plusieurs fois entre le biosimilaire et l’originale - sans perte d’efficacité ni augmentation des effets indésirables.
En France, la notion d’interchangeabilité n’est pas encore juridiquement reconnue pour la substitution automatique en pharmacie. Mais aux États-Unis, 12 biosimilaires sont déjà désignés comme interchangeables. Cela signifie que le pharmacien peut les remplacer sans demander au médecin - à condition que la loi de l’État le permette.
En Europe, la règle est différente : le médecin doit toujours prescrire le produit spécifique, qu’il soit originale ou biosimilaire. La substitution n’est pas autorisée sans accord explicite du prescripteur.
Les différences de connaissance entre professionnels
En 2021, une étude a montré que seuls 38 % des médecins américains se déclaraient « très familiers » avec la définition officielle d’un biosimilaire. En France, les données sont plus rares, mais les observations cliniques sont similaires.
Les pharmaciens hospitaliers connaissent mieux les biosimilaires que les pharmaciens de ville. Les oncologues les utilisent plus que les endocrinologues. Pourquoi ? Parce que les oncologues ont vu les bénéfices en pratique : des économies de 25 à 30 % sur des traitements qui coûtent jusqu’à 10 000 € par an. Et quand les patients peuvent accéder à ces traitements plus longtemps, les résultats s’améliorent.
Un autre fait frappant : les jeunes professionnels sont moins familiers avec les biosimilaires que les plus expérimentés. C’est paradoxal, mais logique : les anciens ont vu l’évolution des traitements, ils ont appris à évaluer les données. Les jeunes, eux, ont été formés dans un système où les biosimilaires étaient encore rares.
Les obstacles réels dans les hôpitaux
Un hôpital sur deux en France a des difficultés à bien documenter les biosimilaires dans les dossiers médicaux électroniques. Pourquoi ? Parce que les systèmes comme Epic ou Cerner n’ont pas été conçus pour distinguer un biosimilaire de son originale. Le pharmacien doit taper manuellement le nom du produit. Si on oublie, on perd la traçabilité.
Et la traçabilité, c’est vital. Si un patient développe une réaction immunitaire, il faut savoir exactement quel produit il a reçu. Pas juste « adalimumab », mais « adalimumab biosimilaire, marque X, lot 2025-01 ».
Les systèmes de facturation posent aussi problème. Les codes de facturation (CPT, HCPCS) sont parfois identiques pour l’originale et le biosimilaire. Ce qui signifie : le système ne sait pas que vous avez prescrit une version moins chère. Et les assureurs ne peuvent pas mesurer les économies réelles.
La formation qui change tout
En 2017, une équipe d’oncologues à l’hôpital de l’Université de Californie a mis en place une série de 12 sessions de formation sur les biosimilaires. Avant : 40 % des médecins doutaient de leur efficacité. Après : 92 % étaient confiants.
Les éléments clés de cette formation ?
- Comprendre la différence entre biosimilaire et générique.
- Apprendre à lire les données d’immunogénicité.
- Savoir ce que signifie l’extrapolation des indications (ex. : un biosimilaire testé sur l’arthrite peut-il être utilisé sur la maladie de Crohn ?).
- Connaître les règles de substitution dans votre région.
- Apprendre à expliquer tout cela aux patients.
Les pharmaciens sont devenus les leaders de cette éducation. Dans 76 % des hôpitaux américains, c’est le pharmacien qui organise les formations, répond aux questions, et vérifie les prescriptions. En France, cette fonction commence à émerger.
Et les patients ?
Les patients ne comprennent pas la différence entre « générique » et « biosimilaire ». Quand vous leur dites : « On va changer votre traitement pour un générique », ils pensent que c’est pareil. Mais ce n’est pas le cas.
Un patient atteint de diabète qui passe d’un insuline originale à un biosimilaire peut avoir peur. Il a peut-être déjà eu des complications. Il ne veut pas prendre de risque.
La clé ? La communication. Ne dites pas : « C’est un générique. » Dites : « C’est une version très similaire du même traitement, testée sur des milliers de patients, et approuvée par l’EMA. Elle coûte 30 % moins cher, et les études montrent qu’elle fonctionne aussi bien. »
Une étude de l’Arthritis Foundation a montré que quand les médecins expliquent clairement, la confusion tombe de 34 % à 8 %. Ce n’est pas une question de prix. C’est une question de confiance.
Et maintenant ?
En 2025, plus de 40 biosimilaires sont disponibles en Europe. Le marché mondial dépasse les 15 milliards d’euros. Les économies pour les systèmes de santé sont estimées à 150 milliards d’euros d’ici 2035.
Mais ces économies ne se feront pas toutes seules. Elles dépendent de vous.
Si vous prescrivez, vous devez comprendre. Si vous dispensez, vous devez documenter. Si vous formez, vous devez être clair.
La bonne nouvelle ? L’Agence européenne des médicaments (EMA) et la FDA ont mis en ligne des ressources gratuites, en français, pour les professionnels. Des modules de 1 à 2 heures, avec des cas cliniques, des quiz, des vidéos. Pas de publicité. Pas de pression. Juste des faits.
Le temps de la confusion est passé. Le moment de l’action est venu.
Un biosimilaire est-il aussi efficace qu’un produit d’origine ?
Oui. Les biosimilaires doivent prouver, par des études rigoureuses, qu’ils n’ont aucune différence cliniquement significative en termes d’efficacité, de sécurité et de qualité par rapport au produit d’origine. Des milliers de patients dans des essais cliniques ont montré des résultats identiques. Des études réelles sur des dizaines de milliers de patients en Europe confirment cette équivalence à long terme.
Pourquoi ne pas remplacer automatiquement un biosimilaire comme un générique ?
Parce que les biosimilaires sont des molécules complexes issues de cellules vivantes, pas des composés chimiques simples. Même de minuscules variations dans leur structure peuvent affecter la réponse immunitaire. La substitution automatique n’est autorisée que pour les biosimilaires désignés comme « interchangeables », et encore, seulement dans certains pays. En France, la prescription doit toujours préciser le produit exact.
Les biosimilaires sont-ils moins chers ?
Oui, généralement entre 15 % et 30 % moins chers que le produit d’origine. Dans certains cas, comme pour les anticorps monoclonaux, les économies dépassent 40 %. Ces réductions permettent à davantage de patients d’accéder à des traitements vitaux, surtout pour les maladies chroniques comme le cancer ou les maladies auto-immunes.
Les biosimilaires peuvent-ils être utilisés pour toutes les indications du produit d’origine ?
Oui, mais seulement si la justification scientifique est solide. C’est ce qu’on appelle l’extrapolation. Par exemple, si un biosimilaire est testé sur la polyarthrite rhumatoïde, il peut être approuvé aussi pour la spondylarthrite ankylosante, si les mécanismes biologiques sont identiques. L’EMA et la FDA exigent des données solides avant d’autoriser cette extrapolation - elle n’est pas automatique.
Où puis-je trouver des ressources pédagogiques fiables en français ?
L’Agence européenne des médicaments (EMA) et la FDA proposent des guides éducatifs gratuits, traduits en français. L’EMA propose des modules sur son site dans la section « Biosimilars ». La FDA a publié une « Teaching Resource Guide » avec 12 modules complets, accessibles en ligne. Ces ressources sont conçues pour les médecins, pharmaciens et infirmiers, sans publicité ni influence industrielle.
vincent PLUTA
janvier 1, 2026 AT 04:33Les biosimilaires, c’est pas du générique, c’est du complexe. Et ça, les pharmaciens de ville l’oublient trop souvent. J’ai vu des patients qui paniquaient parce qu’on leur avait dit « c’est un générique »… alors qu’ils prenaient un anticorps monoclonal. La confusion, c’est la première cause d’abandon de traitement. Il faut former, pas juste informer.
Yseult Vrabel
janvier 2, 2026 AT 22:36On parle de 150 milliards d’euros d’économies d’ici 2035, mais personne ne parle des patients qui meurent parce qu’on a switché sans traçabilité. C’est pas de la médecine, c’est du management de coûts en blouse blanche.
Nicole Frie
janvier 4, 2026 AT 11:42Et les labos qui font des biosimilaires, ils sont tous des voleurs ? Ou juste des gens qui ont compris que la santé, c’est un marché ? 🤔
Martin Viau
janvier 5, 2026 AT 14:09En Canada, on a des biosimilaires depuis 2010. On a pas eu de cataclysme. Les patients s’en fichent un peu, tant que ça marche. La vraie question, c’est pourquoi les médecins français font encore des histoires avec des molécules qui ont 10 ans de données derrière eux. C’est du conservatisme maladif.
Dominique Hodgson
janvier 6, 2026 AT 13:32La traçabilité c’est du bluff. Dans 90% des hôpitaux, personne ne note le lot. Le système informatique est un capharnaüm. On se contente de taper « adalimumab » et hop. Le pharmacien est le seul à savoir ce qu’il y a dans le carton. Et il est surchargé. Alors on fait comme avant. Parce que c’est plus facile.
Alexandra Marie
janvier 6, 2026 AT 23:00Je travaille en hôpital. On a mis en place une checklist pour les biosimilaires. Nom du produit, lot, date, signature du prescripteur. Résultat ? 98% des dossiers sont complets. C’est pas compliqué. C’est juste une question de volonté. Et de temps. Et de reconnaissance du rôle du pharmacien. Qui n’est pas qu’un distributeur de pilules.
Jeanne Noël-Métayer
janvier 7, 2026 AT 10:48Extrapolation des indications ? C’est du pipi de chat. Un biosimilaire testé sur la polyarthrite ne peut pas être extrapolé à la maladie de Crohn sans étude spécifique. C’est de la chimie, pas de la magie. Et pourtant, l’EMA l’autorise. Parce que c’est plus rentable. Pas parce que c’est scientifique.
Alain Sauvage
janvier 8, 2026 AT 18:49Je suis médecin généraliste. J’ai suivi la formation de l’EMA il y a 6 mois. J’ai compris la différence pour la première fois. J’ai eu l’impression d’avoir fait 10 ans de médecine en vain. On nous a menti. Ou on nous a oublié. La formation continue, c’est pas un luxe. C’est une obligation éthique.
fleur challis
janvier 10, 2026 AT 15:57Les biosimilaires, c’est juste la dernière arnaque de Big Pharma pour garder le monopole. Le vrai générique, c’est quand tu peux le fabriquer chez toi avec un kit de biotech. Mais non, il faut 200 millions d’euros pour copier un anticorps. C’est du capitalisme maladif. 😒
Eveline Hemmerechts
janvier 11, 2026 AT 06:51Je suis patiente depuis 12 ans avec un traitement biologique. On m’a proposé un biosimilaire. J’ai dit non. Pas par peur. Parce que je ne veux pas être un cobaye. Je ne suis pas un chiffre dans un tableau d’économie. Et je ne vais pas laisser un pharmacien me remplacer comme un paquet de lessive.
Myriam Muñoz Marfil
janvier 12, 2026 AT 17:19Les jeunes médecins ne connaissent pas les biosimilaires ? Moi j’ai 28 ans et je les prescris depuis 3 ans. On les a étudiés en fac. La formation a changé. Ceux qui disent le contraire, ce sont les mêmes qui refusent les ECGs automatisés en 2010. Le progrès fait peur. Mais il est là.
Elaine Vea Mea Duldulao
janvier 12, 2026 AT 20:54Je suis infirmière en oncologie. Je vois les patients tous les jours. Quand on leur explique calmement, avec des mots simples, ils comprennent. Ils ont peur de l’inconnu, pas du biosimilaire. Il faut juste leur parler. Pas les terroriser. Ni les manipuler. Juste les accompagner.
Clio Goudig
janvier 13, 2026 AT 10:33On parle de 92% de confiance après une formation. Mais qui a financé cette formation ? Qui a écrit les slides ? Qui a mis les logos en bas ? Je ne crois pas aux miracles. Je crois aux intérêts. Et les intérêts, ils ne sont jamais neutres.
Bram VAN DEURZEN
janvier 14, 2026 AT 17:05Il est regrettable que la discussion se limite à des considérations techniques et économiques, alors que la question fondamentale - celle de la dignité du patient face à une médecine de plus en plus standardisée - est totalement absente du débat. L’individu ne peut être réduit à une donnée statistique, ni à un coût unitaire.
Emily Elise
janvier 15, 2026 AT 20:27Je viens de passer 2 heures à expliquer à un patient pourquoi son traitement n’était pas un « générique ». Il a pleuré. Pas de peur. De soulagement. Il a dit : « Je pensais qu’on m’avait fait un lower budget ». J’ai vu sa main trembler. Ce n’est pas un problème de médecine. C’est un problème de communication. Et ça, c’est notre faute. À nous, les professionnels. Pas aux labos. Pas aux systèmes. À nous.