IBD Biologiques : Anti-TNF, Anti-Intégrine et Inhibiteurs IL-12/23
 févr., 19 2026
févr., 19 2026
Les maladies inflammatoires de l’intestin (MIIs), comme la maladie de Crohn et la rectocolite hémorragique, touchent des millions de personnes dans le monde. Pendant des années, les traitements se limitaient aux corticoïdes et aux immunosuppresseurs, souvent inefficaces ou trop toxiques. Aujourd’hui, les biologiques ont révolutionné la prise en charge. Ces médicaments ciblent précisément les molécules du système immunitaire qui attaquent à tort l’intestin. Trois familles dominent : les anti-TNF, les anti-intégrines et les inhibiteurs de l’IL-12/23. Chacune agit différemment, avec des avantages et des inconvénients propres.
Les anti-TNF : les pionniers de la thérapie ciblée
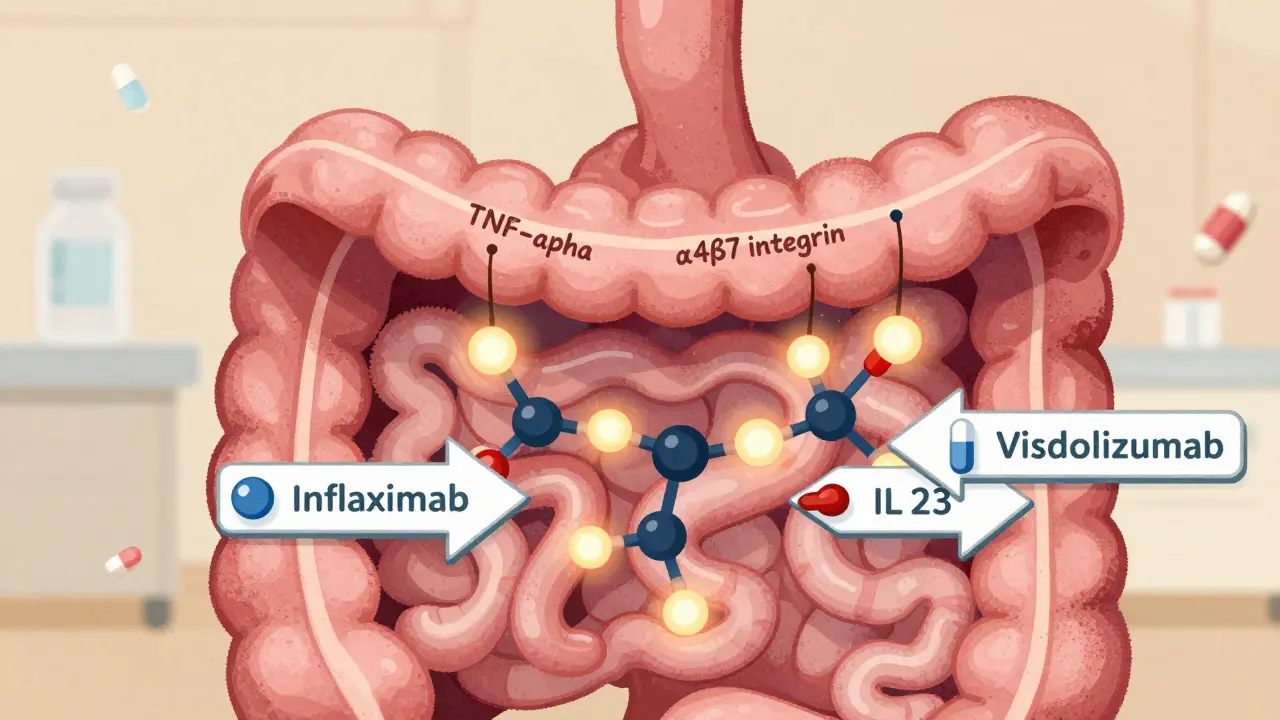
Les anti-TNF ont été les premiers biologiques à arriver sur le marché. Leur cible : la protéine TNF-alpha, un messager chimique qui amplifie l’inflammation dans l’intestin. Infliximab (Remicade) a été approuvé pour la maladie de Crohn en 1998, puis pour la rectocolite hémorragique en 2005. Adalimumab (Humira) est arrivé peu après, en 2007, et a rapidement gagné en popularité grâce à son mode d’administration : une injection sous-cutanée à domicile, toutes les deux semaines. Golimumab et certolizumab pegol complètent cette famille.
Leur efficacité est bien documentée. Une méta-analyse de 2022 montre qu’infliximab atteint une rémission clinique chez 85 % des patients naïfs aux biologiques, contre 31 % pour adalimumab. Pour la guérison de la muqueuse intestinale, infliximab l’emporte aussi largement. Pourtant, ces différences ne sont pas toujours visibles dans la pratique. Une étude autrichienne sur 362 patients n’a pas trouvé de différence significative entre infliximab et adalimumab en termes de rémission à un ou deux ans.
Leur principal défaut ? Le risque d’infections graves. Les anti-TNF augmentent de 30 à 50 % le risque de tuberculose, d’infections bactériennes sévères ou de réactivation du virus de l’hépatite B. Ils peuvent aussi déclencher des réactions d’hypersensibilité pendant l’infusion - fréquentes avec infliximab, avec jusqu’à 42 % des patients rapportant des symptômes comme des rougeurs, des démangeaisons ou des nausées. Et si le traitement perd de son efficacité au fil du temps (ce qui arrive chez 6 à 25 % des patients), il faut augmenter la dose ou associer un immunosuppresseur comme l’azathioprine.
Les anti-intégrines : une approche plus ciblée
Vedolizumab (Entyvio) est le seul anti-intégrine disponible aujourd’hui. Il bloque une protéine appelée α4β7, présente uniquement sur les lymphocytes qui migrent vers l’intestin. Contrairement aux anti-TNF, il ne touche pas le système immunitaire au niveau du cerveau, des poumons ou de la peau. Cela le rend plus sûr pour les patients ayant un risque de sclérose en plaques, d’infections chroniques ou de tuberculose latente.
Il est administré par perfusion intraveineuse, à 0, 2, 6 semaines puis toutes les 8 semaines. Son point faible ? Sa lenteur. Il faut souvent 6 à 10 semaines avant de voir un effet réel. Sur MyIBDTeam, 44 % des patients mentionnent cette attente comme un gros inconvénient. Pourtant, sa sécurité est remarquable : seulement 18 % des utilisateurs rapportent des effets secondaires, contre 58 % pour Humira. Une étude a montré que les patients sous vedolizumab ont moins tendance à être hospitalisés pour leur MII que ceux sous anti-TNF.
Un autre anti-intégrine, l’etrolizumab, est actuellement en phase 3 d’essais cliniques. Il cible un mécanisme similaire mais pourrait offrir une administration sous-cutanée à l’avenir. Pour l’instant, vedolizumab reste la seule option de cette classe.
Les inhibiteurs IL-12/23 et IL-23 : la nouvelle génération
Les interleukines IL-12 et IL-23 sont des molécules clés dans l’inflammation chronique de l’intestin. Ustekinumab (Stelara) bloque les deux, tandis que les nouveaux médicaments - risankizumab (Skyrizi) et mirikizumab (Omvoh) - ne ciblent que l’IL-23. Cette précision réduit les effets secondaires.
Ustekinumab est injecté sous-cutanément toutes les 8 ou 12 semaines, selon le poids du patient. Approuvé pour la maladie de Crohn en 2016 et la rectocolite hémorragique en 2019, il a prouvé son efficacité chez les patients qui n’ont pas répondu aux anti-TNF. Mais son principal atout est sa simplicité : pas besoin de perfusion, pas de risque de réaction d’hypersensibilité majeure, et un profil de sécurité plus doux que les anti-TNF.
En juin 2024, la FDA a approuvé risankizumab pour la rectocolite hémorragique. C’est la première fois qu’un inhibiteur IL-23 est autorisé pour les deux formes de MII. L’essai ADVENT a montré que 29 % des patients étaient en rémission après 52 semaines, contre seulement 10 % sous placebo. Ce chiffre est impressionnant. De plus, les effets secondaires sont rares : infections légères, maux de tête, parfois des éruptions cutanées. Aucun cas de tuberculose ou de cancer lié à ce médicament n’a été rapporté dans les essais.
Comparaison directe : efficacité, sécurité et confort
Pas de traitement idéal pour tout le monde. Le choix dépend de la maladie, de la gravité, des antécédents médicaux et même du mode de vie.
| Biologique | Classe | Administration | Effet début | Risque d’infections graves | Coût approx. (par dose) |
|---|---|---|---|---|---|
| Infliximab | Anti-TNF | Perfusion IV (2-4 h) | 2-4 semaines | Élevé | $4 800 |
| Adalimumab | Anti-TNF | Injection SC (toutes les 2 semaines) | 2-4 semaines | Élevé | $7 200 |
| Vedolizumab | Anti-intégrine | Perfusion IV (1 h) | 6-10 semaines | Faible | $5 500 |
| Ustekinumab | IL-12/23 | Injection SC (toutes les 8-12 semaines) | 4-6 semaines | Moyen | $7 200 |
| Risankizumab | IL-23 | Injection SC (toutes les 4 semaines) | 4-8 semaines | Très faible | $8 100 |
Les données révèlent un paradoxe : infliximab est le plus efficace pour les cas sévères, mais adalimumab est le plus prescrit - sans doute pour sa commodité. Vedolizumab gagne en popularité chez les patients qui ont peur des infections ou qui ont déjà eu des complications avec les anti-TNF. Risankizumab, bien que plus cher, pourrait devenir le nouveau standard pour les patients qui n’ont pas répondu aux autres traitements.
Coûts, accès et réalité du terrain
Les biologiques sont coûteux. Une dose de vedolizumab coûte environ 5 500 $, celle d’ustekinumab 7 200 $. Mais la réalité financière est plus nuancée. Les programmes d’aide des laboratoires (comme Janssen CarePath) permettent à 95 % des patients d’être facturés 0 à 5 $ par perfusion. Les biosimilaires d’infliximab et d’adalimumab, disponibles depuis 2016, ont réduit les coûts de 15 à 30 %.
Malgré cela, 25 % des patients déclarent avoir des difficultés à obtenir leur traitement par manque de couverture d’assurance. Les infusions nécessitent des déplacements répétés - 8 heures de trajet aller-retour pour certains. C’est insoutenable pour les personnes vivant loin des centres spécialisés. Beaucoup préféreraient une injection à domicile, même si elle est moins efficace. Une enquête de 2023 montre que 63 % des patients changeraient de traitement pour éviter les perfusions.
Le soutien existe : les applications comme MyTherapy aident 68 % des patients à ne pas oublier leurs doses. Le Centre d’aide aux MIIs (888-694-8872) fournit des conseils pratiques et un accompagnement psychologique. Mais l’accès inégal reste un problème majeur.
Quel traitement choisir ?
Pas de règle unique. Pour un patient jeune, sévère, sans autre maladie : infliximab reste le meilleur choix selon les données. Pour quelqu’un avec un risque de tuberculose ou une histoire de sclérose en plaques : vedolizumab ou ustekinumab. Pour un patient qui veut éviter les hôpitaux : adalimumab ou risankizumab.
Les experts s’accordent sur un point : les essais comparatifs directs sont rares. La plupart des données viennent de méta-analyses qui mélangent des essais différents. Cela rend les recommandations plus délicates. Certains médecins préfèrent commencer par les anti-TNF, d’autres par les nouveaux inhibiteurs IL-23. La tendance évolue : d’ici 2028, les inhibiteurs IL-23 pourraient représenter 30 % du marché, contre 65 % pour les anti-TNF aujourd’hui.
Le futur ? Des traitements personnalisés. Des biomarqueurs sanguins ou génétiques pourraient bientôt dire quel médicament fonctionnera le mieux pour vous - sans essai-erreur. Des essais comme RHEA et VEGA, en cours jusqu’en 2026, devraient apporter des réponses claires. Pour l’instant, le choix reste un compromis entre efficacité, sécurité, confort et coût.
Quel est le biologique le plus efficace pour la maladie de Crohn ?
Pour les patients n’ayant jamais pris de biologique, infliximab montre la meilleure efficacité dans les études, avec des taux de rémission et de guérison de la muqueuse supérieurs à ceux d’adalimumab ou de vedolizumab. Cependant, pour les patients qui ont déjà échoué à un anti-TNF, ustekinumab ou risankizumab sont souvent plus efficaces. Il n’existe pas de « meilleur » traitement universel.
Pourquoi certains patients préfèrent-ils vedolizumab malgré son effet lent ?
Vedolizumab agit uniquement dans l’intestin, sans affecter le système immunitaire général. Cela réduit considérablement les risques d’infections graves, de tuberculose ou de maladies neurologiques comme la sclérose en plaques. Pour les patients à risque, cette sécurité l’emporte sur la lenteur d’action. De plus, seulement 18 % des utilisateurs rapportent des effets secondaires, contre plus de 50 % pour les anti-TNF.
Les biosimilaires sont-ils aussi efficaces que les médicaments d’origine ?
Oui. Les biosimilaires d’infliximab (Inflectra, IXIFI) et d’adalimumab (Cyltezo) sont des versions très similaires aux médicaments d’origine, avec des profils d’efficacité et de sécurité presque identiques. Ils sont approuvés par la FDA et l’EMA. Leur principal avantage est le prix : ils coûtent 15 à 30 % moins cher, ce qui améliore l’accès.
Quels sont les risques à long terme des biologiques ?
Les anti-TNF augmentent légèrement le risque de lymphomes et de cancers de la peau. Les inhibiteurs IL-23 comme risankizumab n’ont montré aucun lien avec ces cancers dans les essais à ce jour. Tous les biologiques augmentent le risque d’infections. C’est pourquoi il est impératif de faire les vaccins (grippe, pneumocoque, hépatite B) avant de commencer le traitement. Un dépistage de la tuberculose est obligatoire pour tous.
Puis-je arrêter un biologique si je me sens bien ?
Non, sans supervision médicale. Arrêter un biologique peut entraîner une rechute dans 50 à 70 % des cas dans les 12 mois. Même en rémission, la maladie peut continuer à progresser à bas bruit. Certains patients peuvent réduire la dose ou espacer les injections sous surveillance stricte, mais l’arrêt complet est rarement recommandé.
Ludovic Briday
février 19, 2026 AT 18:59Les anti-TNF, c’est un peu comme utiliser un marteau-piqueur pour démonter une montre suisse. Très efficace, mais avec un risque de dégâts collatéraux énorme. J’ai vu des patients qui, après deux ans d’infliximab, se retrouvaient avec une pneumonie fongique et une réactivation de l’hépatite B. Le tout pour une rémission qui disparaissait au bout de six mois. La médecine moderne nous a fait croire que plus ciblé = mieux, mais la réalité du terrain, c’est que le système immunitaire, c’est un écosystème, pas un interrupteur.
Et pourtant, on continue à prescrire comme si on pouvait éteindre l’inflammation sans conséquence. On oublie que la muqueuse intestinale, c’est la première barrière entre le monde extérieur et notre corps. La détruire pour la réparer, c’est un peu comme brûler sa maison pour en construire une plus grande. Il faut repenser la stratégie globale, pas juste changer de molécule.